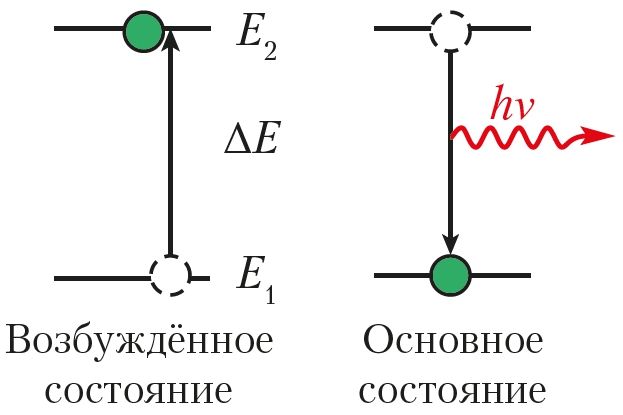
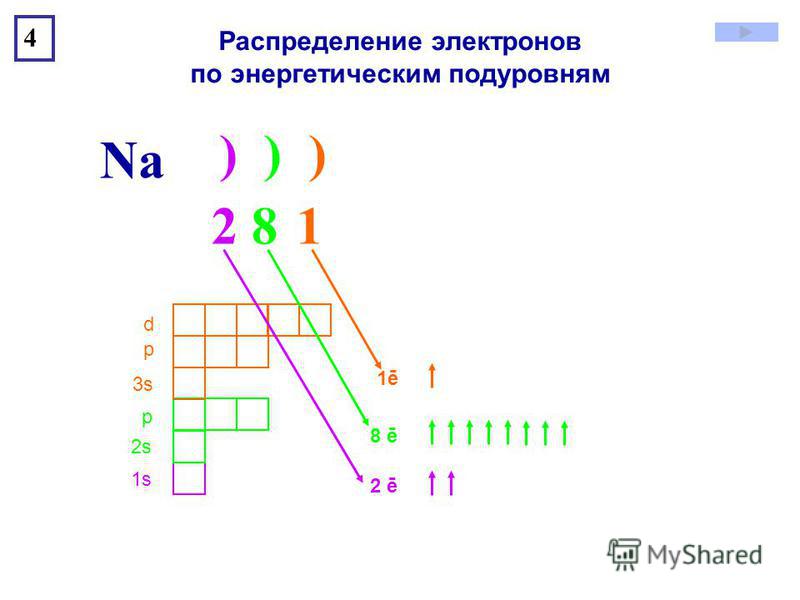
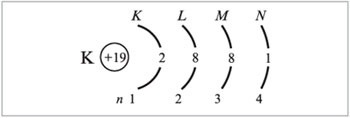
Схема распределения электронов по энергетическим уровням
§ 9. Состояние электрона в атоме
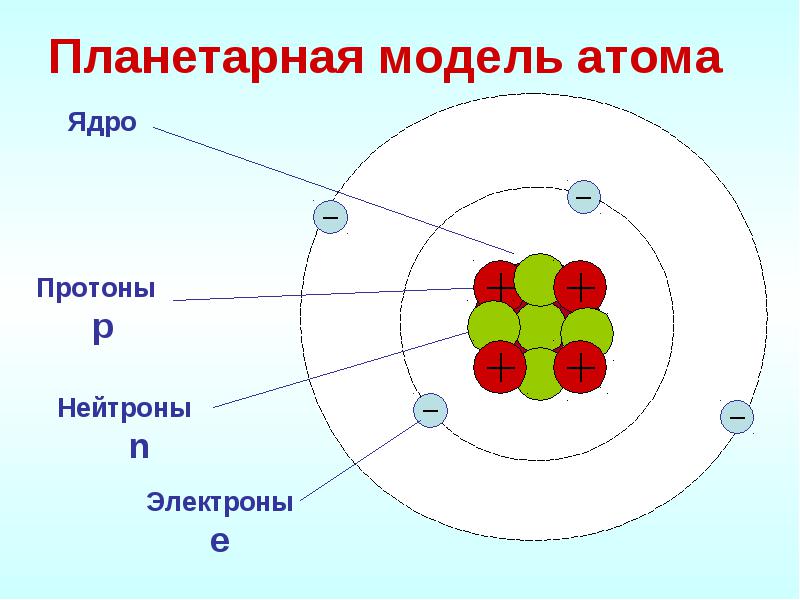
Удобная навигация, видео-разборы тем, задачи для самопроверки — всё это в вашем кармане. А ещё раздел с полезными материалами, календарь занятий и уведомления о предстоящих уроках. В химических реакциях ядра атомов не изменяются. Было установлено, что все химические свойства веществ определяются строением электронных оболочек атомов.
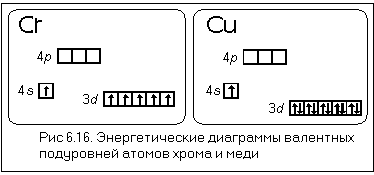
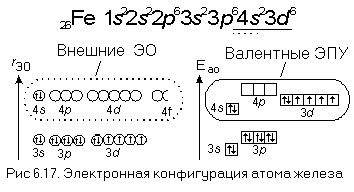

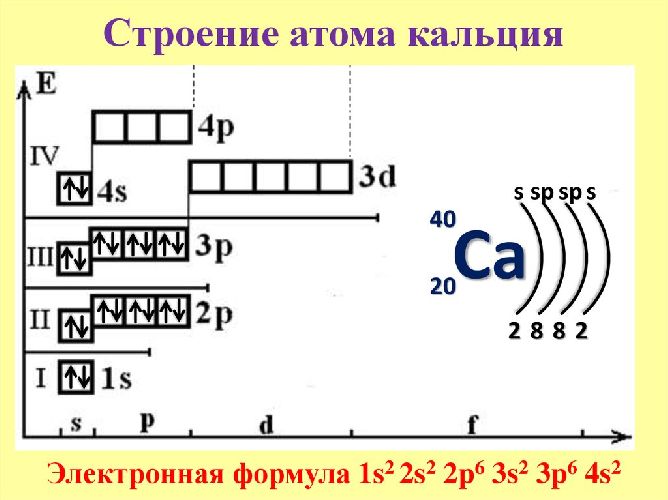
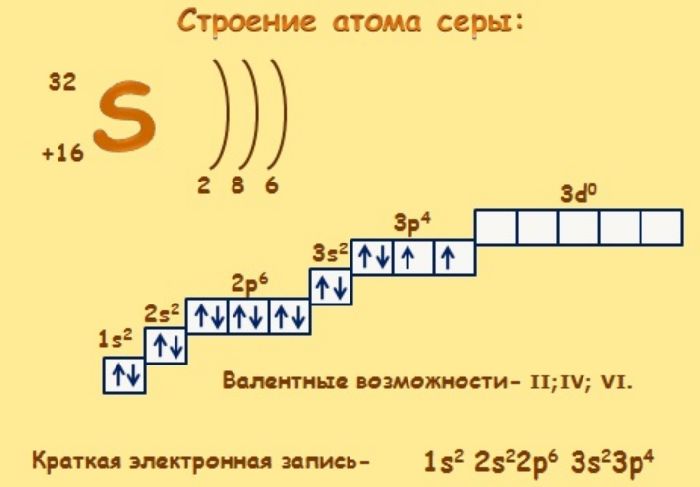

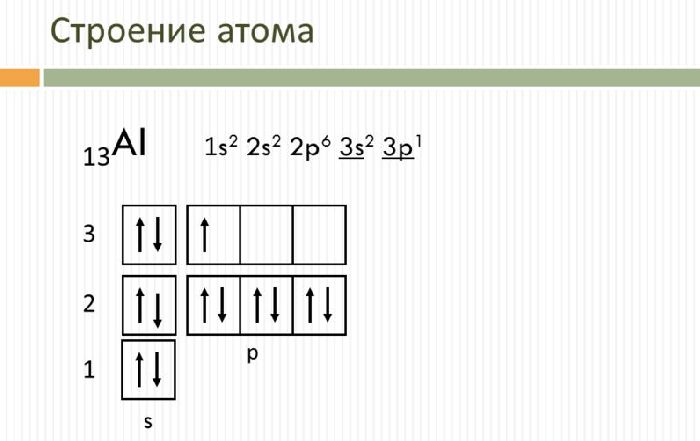

Маделунгом ; в г. По мере увеличения заряда ядра в водородоподобных атомах атомные орбитали заселяются таким образом, что появление электронов на орбитали с более высокой энергией зависит только от главного квантового числа n и не зависит от всех остальных квантовых чисел, в том числе и от l. Физически это означает, что в водородоподобном атоме орбитальная энергия электрона определяется только пространственной удаленностью зарядовой плотности электрона от ядра и не зависит от особенностей его движения в поле ядра. Поэтому энергетическая последовательность орбиталей в водородоподобном атоме выглядит просто:. Здесь орбитальная энергия электрона повышается только по мере увеличения главного квантового числа n и не меняется при увеличении орбитального квантового числа l ; состояния с различными значениями l , но с одним и тем же значением n например, 3 s , З р , 3 d энергетически эквивалентны, то есть соответствующие атомные орбитали 3 s , З р , 3 d обладают одинаковой энергией и оказываются энергетически вырожденными не следует путать обсуждаемое вырождение по энергии атомных орбиталей различного типа в гипотетических водородоподобных атомах с энергетическим вырождением атомных орбиталей одного и того же типа, например З р x , З р у и З р z в реальных изолированных атомах.
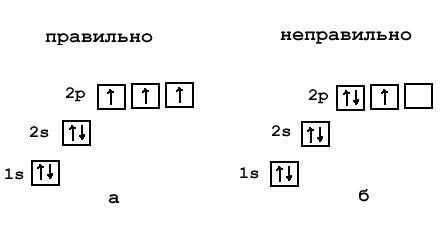

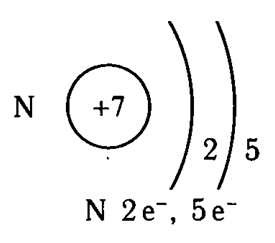
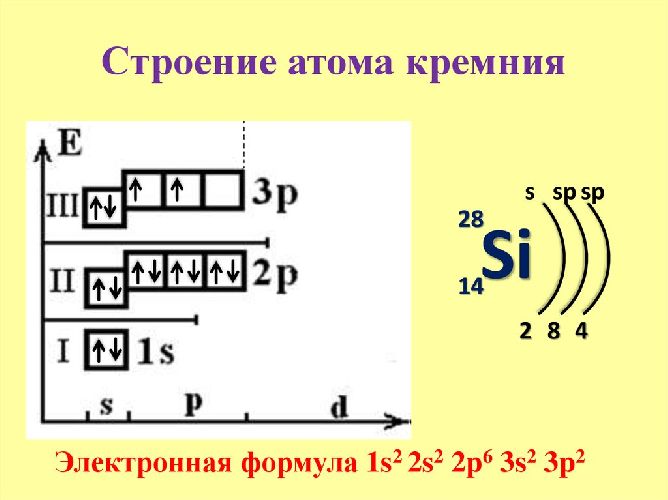


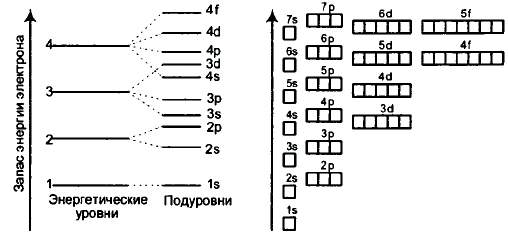

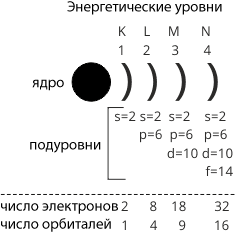
Первый способ : Электроны легко можно распределить по подуровням исходя из некоторых правил. Во первых нужна цветная таблица. Представим каждый элемент как один новый электрон, Каждый период — это соответствующий уровень, s. Просто берём таблицу и читаем исходя из цвета элемента, у s, p- элементов номер уровня соответствует номеру периода, если доходим до d-элемента пишем уровень на один меньше, чем номер периода, в котором этот элемент находится если элемент в 4-м периоде, следовательно, 3 d. Также поступаем и с f-элементом, только уровень указываем меньше чем номер периода на 2 значения если элемент в 6-м периоде, следовательно, 4 f. Второй способ : Нужно отобразить все подуровни в виде одной клеточки, и уровни расположить друг под другом симметрично подуровень под подуровнем.